2024年2月6日,我室霍然课题组和军事科学院军事医学研究院舒文杰课题组合作在Developmental Cell 杂志在线发表了题为Maternal KLF17 controls zygotic genome activation by acting as a messenger for RNA Pol II recruitment in mouse embryos的研究论文,报道了母源转录因子KLF17通过影响RNA聚合酶II的招募从而参与小鼠ZGA的调控过程。

研究团队发现,在受精后添加翻译抑制剂—放线菌酮(Cycloheximide,CHX)来抑制晚期一细胞胚胎的蛋白合成,会导致ZGA和早期胚胎发育受到严重影响。为了深入了解ZGA启动前的翻译产物,该研究采用了TMT标记的定量蛋白质组学技术来鉴定CHX处理后的差异蛋白,将CHX处理后翻译受到抑制的下调蛋白作为调控ZGA的候选因子,并从中筛选出KLF17作为可能的ZGA调控关键因子。值得注意的是,在通过蛋白质组学方法直接鉴定出的翻译产物中,有81.46% 的蛋白来源于母源转录本。这些包括KLF17在内的蛋白在功能上显著富集于转录调控通路。同时,这一通路中也鉴定到了若干已知的参与ZGA调控的重要蛋白,如DUX (Gm4981) 2,YAP 3,KDM1A 4,NFYA 5和OBOX2/5/76。因此,本研究强烈提示,ZGA启动前母源转录调控蛋白的翻译可能为ZGA的启动提供了转录所需的“发令信号”。
为了验证KLF17的功能,研究团队构建了卵母细胞特异性敲除小鼠模型,将其与野生型雄鼠交配后发现母源Klf17缺失(Klf17 matKO)的胚胎中部分存在二细胞发育阻滞的现象。进一步的研究表明,Klf17 matKO胚胎中ZGA受到损害,而当向这些胚胎中注射外源性Klf17 mRNA时,能够部分挽救ZGA和早期胚胎发育的缺陷。通过对RNA-seq和Stacc-seq数据的联合分析,研究者们发现,在早期二细胞胚胎中,KLF17会优先结合在ZGA基因的启动子区域,这一现象与RNA聚合酶II“预配置”状态相似(详见Bioart报道:Nature丨颉伟组发表哺乳动物合子基因组激活过程中RNA聚合酶参与转录起始的调控机理)【7】。此外,通过对KLF17和RNA聚合酶II在早期二细胞胚胎基因组上结合信号的联合分析,发现RNA聚合酶II的信号会显著富集在有KLF17结合的启动子区域。然而,在Klf17 matKO胚胎中,RNA聚合酶II在ZGA基因上的“预配置”信号减低,导致这部分ZGA基因无法正常激活;向Klf17 matKO胚胎中注射外源性Klf17 mRNA可在一定程度上挽救这一缺陷。上述发现表明,母源KLF17对于ZGA正常激活是不可或缺的,其作为ZGA转录活动的“送信者”,能够将RNA聚合酶II投送至胚胎基因组的特定位点,从而促使ZGA发生。
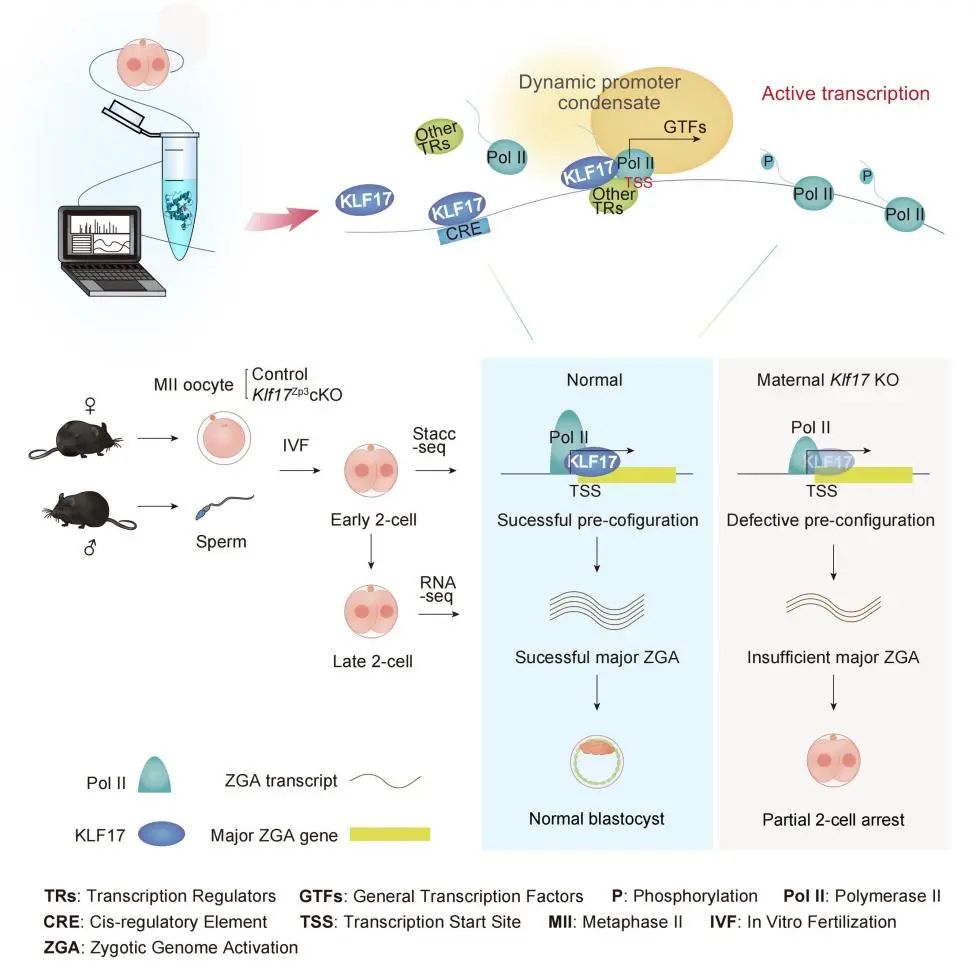
图1. 母源KLF17在早期胚胎发育过程中通过参与RNA Pol II “预配置” 调控合子基因组激活。
综上,本项研究通过对受精后翻译蛋白的解析,成功鉴定出了一个新的参与小鼠ZGA调控的母源转录因子—KLF17,并明确了母源KLF17在小鼠早期胚胎发育以及RNA聚合酶II“预配置”介导的ZGA过程中发挥的重要作用。这一研究丰富了对哺乳动物ZGA转录因子的认识,为深入理解哺乳动物早期胚胎发育和ZGA精确转录调控的机制提供了新的线索。
南京医科大学生殖医学与子代健康全国重点实验室博士后胡月、军事科学院军事医学研究院王俞翔和南京医科大学何元林副教授为该论文共同第一作者;南京医科大学生殖医学与子代健康全国重点实验室霍然教授和军事科学院军事医学研究院舒文杰教授为该论文通讯作者;同时,该项研究工作得到了南京医科大学胡志斌教授、沙家豪教授、郭雪江教授、李朝军教授,清华大学颉伟教授和刘伯峰博士等老师和同学的大力支持。
