近日,我室徐志鹏团队与基础医学院病原生物学系季旻珺、中科院上海药物研究所周子凯团队合作在《细胞报告》(Cell Reports)上发表了研究论文:母胎界面免疫系统的再平衡改善成年子代孤独症样行为(The rebalancing of the immune system at the maternal-fetal interface ameliorates autism-like behavior in adult offspring)。该研究从动物模型角度首次提出母体免疫激活(MIA)诱导母胎界面Treg细胞失衡与子代孤独症谱系障碍(ASD)的密切联系,丰富了ASD发病的母体免疫激活(MIA)机制内容,解析了ASD的“健康和疾病的发育起源(DOHaD)”学说,并提出了通过诱导Treg细胞“靶向调节MIA”的ASD早期预防策略,为ASD以及其他精神类疾病的临床早期干预提供新思路。
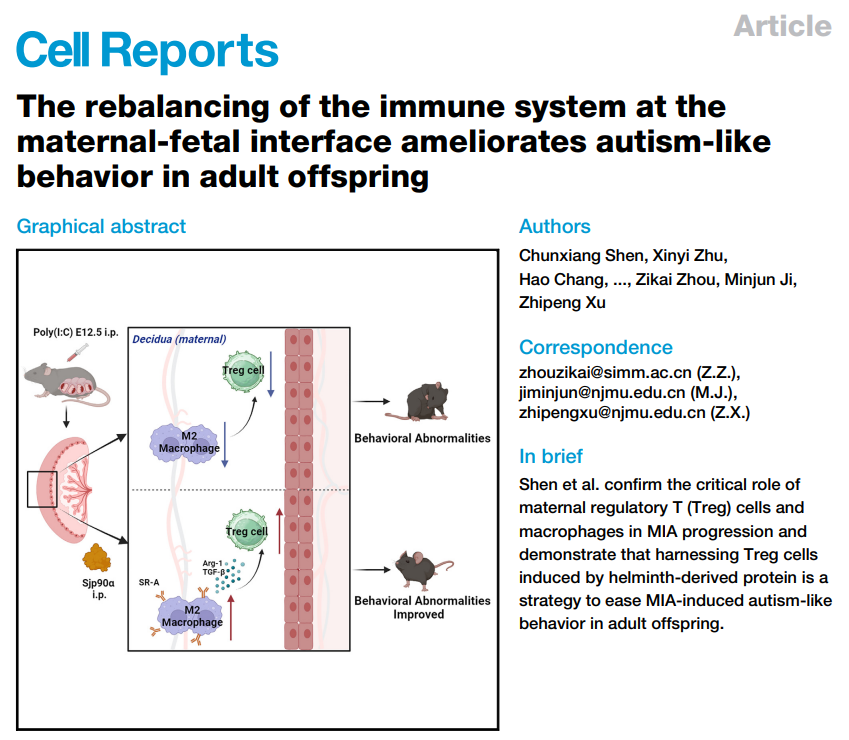
母体免疫激活(MIA)被认定为母体感染引发子代孤独症谱系障碍(ASD)的关键诱因。母胎界面微环境不仅可以维持母胎免疫耐受,也可以为胚胎发育提供营养支持。然而迄今,母胎界面免疫微环境是否与MIA有关,尤其是其对MIA诱导的子代神经发育障碍的作用尚不明确,亟需深入研究。
本研究从动物模型角度首次阐述了母胎界面免疫细胞在母体免疫激活(MIA)致子代ASD中的作用。团队首先采用scRNA-seq技术分析了PBS和Poly(I: C)诱导的MIA孕鼠的母胎界面构成单细胞转录组学景观,发现Poly(I: C)-MIA孕鼠胎盘出现显著的促炎表型,伴随着调节性T(Treg)细胞数量减少,并明确该现象是由于MIA诱导的局部Treg细胞凋亡增加导致。鉴于蜕膜巨噬细胞在诱导CD4+T细胞分化的过程中起着关键作用,研究团队进一步对MIA诱导的孕鼠体内巨噬细胞进行分析,发现MIA孕鼠体内(胎盘、脾脏、腹腔)巨噬细胞呈现显著的M1极化表型,而当清除MIA孕鼠体内炎性巨噬细胞能够改善成年后代孤独症样行为,包括病鼠社交互动缺陷、重复刻板动作等孤独症核心症状。
基于卫生假说(Hygiene hypothesis)的蠕虫疗法(Helminthic therapy)防治免疫相关性疾病的策略受到广泛关注,该疗法聚焦在蠕虫与宿主长期进化过程中演变出的逃避宿主免疫系统的调控机制,进而可通过调节宿主免疫平衡发挥防治免疫(炎症)相关疾病的效应。本研究研发了日本血吸虫来源的热休克蛋白90α(Sjp90α,与哺乳动物HSP90α具有60.77%的同源性)对MIA孕鼠Treg细胞的诱导作用,抑制MIA孕鼠胎盘及胎脑的促炎性反应,并改善MIA诱导的成年后代孤独症样行为。机制上,团队发现Sjp90α诱导MIA孕鼠CD4+T细胞向Treg细胞分化依赖于巨噬细胞的存在,并进一步揭示其诱导作用是以细胞与细胞非接触依赖的方式实现。研究还初步证明了Sjp90α诱导MIA孕鼠母胎界面的M2巨噬细胞的潜在作用机制—即通过与巨噬细胞SR-A受体结合实现,为后续深入研究提供了依据和思路。
南京医科大学徐志鹏、季旻珺以及中科院上海药物研究所周子凯为共同通讯作者。南京医科大学博士生沈春香和朱欣熠为并列第一作者。该研究团队长期聚焦在母体免疫激活致子代精神类疾病的基础与转化研究,前期已取得原创成果,相关论著发表于Nature Neuroscience,2021等权威期刊。
文章链接:
https://www.sciencedirect.com/science/article/pii/S2211124724011380?via%3Dihub

